Calorimetria
O estudo dos fenômenos de transferência de calor
Paulo Augusto Bisquolo*
Especial para a Página 3 Pedagogia & Comunicação
Especial para a Página 3 Pedagogia & Comunicação
A calorimetria é a parte da física que estuda os fenômenos decorrentes da transferência dessa forma de energia chamada calor.
Na natureza encontramos a energia em diversas formas. Uma delas, que é muito importante, é o calor. Para entendê-lo, pense em uma xícara de café quente sobre a sua mesa. Após algum tempo esse café estará frio, ou melhor, com a mesma temperatura que o ambiente. Esse fenômeno não é uma exclusividade da xícara de café quente, mas ocorre com todos os corpos que estão em contato de alguma forma e com temperaturas diferentes. Por que isso ocorre?
O que se observa é que quanto mais quente está o corpo, maior é a agitação molecular e o inverso também é verdadeiro, ou seja, a temperatura é uma grandeza física que está associada de alguma forma ao estado de movimentação ou agitação das moléculas.
<>
A temperatura, atualmente, pode ser medida em três escalas termométricas. Celsius, Fahrenheit e Kelvin. A conversão entre essas escalas pode ser feita pelas seguintes relações matemáticas:
<>
<>
Após algum tempo, observamos que esses dois corpos encontram-se com a mesma temperatura. O que estava com maior temperatura esfriou e o que estava com menor temperatura esquentou. Quando isso ocorre, dizemos que os corpos estão em equilíbrio térmico e a temperatura final é chamada de temperatura de equilíbrio.
Isso acontece porque o corpo de maior temperatura fornece certa quantidade de energia térmica para o outro de menor temperatura. Essa energia térmica quando está em transito de um corpo para outro é denominada calor.
<>
Para isso, primeiramente, irá aquecer certa quantidade de água. Uma atitude inteligente a ser tomada é colocar exatamente a quantidade de água necessária para isso, pois se você colocar a água em demasia, irá demorar mais tempo para ela chegar à temperatura desejada, além do fato de que o macarrão irá parecer mais uma sopa. Mas, independentemente do resultado final da atividade culinária, o importante para nós é observar que quanto mais água houver na panela, maior será a quantidade de calor necessária para se atingir a temperatura desejada e por isso ela terá uma capacidade térmica maior.
Podemos, então, concluir que a capacidade térmica depende diretamente da massa do corpo e, portanto, pode ser calculada da seguinte forma:
<>
Onde c é o calor específico sensível da substância de que o corpo é constituído. O calor específico pode ser definido como a capacidade térmica por unidade de massa e é uma característica da substância de que o material é feito.
Observe que estamos falando de uma mesma substância, a água, que quando possui massas diferentes, possui capacidades térmicas diferentes, ou seja, a capacidade térmica é uma propriedade do corpo, e isso é aplicado a outras substâncias na natureza.
A capacidade térmica pode ser medida usualmente em e no Sistema Internacional em
e no Sistema Internacional em  , assim como o calor específico é medido usualmente em
, assim como o calor específico é medido usualmente em  e, no Sistema Internacional em
e, no Sistema Internacional em  .
.
<>
Essa equação é conhecida como a equação fundamental da calorimetria e mostra que o calor sensível depende da massa (m), do calor específico (c) e da variação de temperatura do corpo ( ).
).
Nesse caso, ele está sendo usado para alterar o grau de ligação delas. Por exemplo, quando derretemos um corpo, o calor está sendo usado para uma mudança no estado de agregação das moléculas o que o fará, no final, atingir o estado líquido.
Outro fato observado é que quanto mais calor é fornecido para a mudança de estado físico, maior será a massa da substância que sofreu essa transformação. Sendo Q a quantidade de calor trocada para a mudança de estado físico e m, a massa transformada, teremos a seguinte relação:
<>
A grandeza L é conhecida como calor latente específico e pode ser determinada em , ou no Sistema Internacional em
, ou no Sistema Internacional em  .
.
<>
A barra está sendo aquecida em uma extremidade, isso fará que as moléculas que ali se encontram aumentem o seu estado de agitação, e isso irá passar para as moléculas vizinhas aumentando o estado de agitação dessas. Após algum tempo a mão que está segurando a barra sentirá a temperatura aumentar.
Em alguns corpos, esse processo ocorre muito rapidamente, como por exemplo, os metais, e por isso eles são chamados de condutores térmicos, e em outros ocorre o contrário, como por exemplo, a madeira e a água. Esses são chamados de isolantes térmicos.
Em dia frio, é comum usarmos agasalhos grossos para nos proteger das temperaturas baixas. Fazemos isso porque o nosso organismo está a uma temperatura maior que o meio ambiente e por isso estamos propensos a ceder calor. O agasalho não permite que isso aconteça, pois ele é feito de materiais que são isolantes térmicos.
<>
Ao se aquecer o recipiente por baixo, a porção de liquido que se encontra na parte inferior irá se aquecer rapidamente. Esse por sua vez dilata e se torna menos denso e, por isso, acaba subindo para a parte superior. O liquido que está em cima está mais frio e mais denso e, por isso, desce. Assim se estabelece uma corrente pela qual o calor é transmitido. Essa corrente é denominada corrente de convecção.
Um exemplo prático é a instalação dos aparelhos de ar condicionado que deve ser feita na parte superior do ambiente. Quando ele é ligado, emite o ar frio que, por ser mais denso, desce para a porção inferior da sala, criando assim uma corrente de convecção e deixando a temperatura ambiente homogênea mais rapidamente.
A irradiação é um processo que pode ocorrer no vácuo e também nos meios materiais, e a sua transmissão é feita por intermédio de ondas eletromagnéticas da faixa do infravermelho. Essas ondas transmitem energia e são absorvidas pelos corpos. Essa absorção provoca uma alteração no estado de movimentação das moléculas alterando, assim, a sua temperatura.
Alguns materiais, como o vidro, são transparentes à radiação visível, mas opacos à radiação infravermelha. Quando deixamos um carro estacionado em um dia ensolarado, o interior se torna muito quente, pois o vidro permite que a luz solar passe. Essa, por sua vez, ao incidir nos objetos que ali estão, fará com que os mesmos emitam a radiação infravermelha. Como o vidro é opaco a essa radiação, ela ficará presa no interior do veículo, fazendo que a temperatura interna se torne mais alta que a externa. Em outras palavras, o carro funcionará como uma estufa.
Na natureza encontramos a energia em diversas formas. Uma delas, que é muito importante, é o calor. Para entendê-lo, pense em uma xícara de café quente sobre a sua mesa. Após algum tempo esse café estará frio, ou melhor, com a mesma temperatura que o ambiente. Esse fenômeno não é uma exclusividade da xícara de café quente, mas ocorre com todos os corpos que estão em contato de alguma forma e com temperaturas diferentes. Por que isso ocorre?
Temperatura
Os objetos na natureza, assim como nós, são feitos de pequenas partículas que conhecemos como moléculas. Com elas ocorre algo invisível. Elas estão em constante estado de agitação, no caso dos sólidos, ou de movimentação, como ocorre em líquidos ou gases. Essa situação não é constante, elas podem estar mais ou menos agitadas, dependendo do estado energético em que elas se encontram.O que se observa é que quanto mais quente está o corpo, maior é a agitação molecular e o inverso também é verdadeiro, ou seja, a temperatura é uma grandeza física que está associada de alguma forma ao estado de movimentação ou agitação das moléculas.
 |
| A temperatura no recipiente 2 é maior do que no recipiente 1, pois lá a movimentação molecular é maior. |
A temperatura, atualmente, pode ser medida em três escalas termométricas. Celsius, Fahrenheit e Kelvin. A conversão entre essas escalas pode ser feita pelas seguintes relações matemáticas:
 |
Calor
Considere dois corpos, A e B, que possuem temperaturas diferentes e estão em contato térmico, como ilustra a figura abaixo: |
Após algum tempo, observamos que esses dois corpos encontram-se com a mesma temperatura. O que estava com maior temperatura esfriou e o que estava com menor temperatura esquentou. Quando isso ocorre, dizemos que os corpos estão em equilíbrio térmico e a temperatura final é chamada de temperatura de equilíbrio.
Isso acontece porque o corpo de maior temperatura fornece certa quantidade de energia térmica para o outro de menor temperatura. Essa energia térmica quando está em transito de um corpo para outro é denominada calor.
 |
Capacidade térmica e calor específico sensível
Os corpos e as substâncias na natureza reagem de maneiras diferentes quando recebem ou cedem determinadas quantidades de calor. Alguns esquentam mais rápido que os outros. Podemos exemplificar isso com a seguinte situação: você está com fome e pretende fazer um macarrão instantâneo.Para isso, primeiramente, irá aquecer certa quantidade de água. Uma atitude inteligente a ser tomada é colocar exatamente a quantidade de água necessária para isso, pois se você colocar a água em demasia, irá demorar mais tempo para ela chegar à temperatura desejada, além do fato de que o macarrão irá parecer mais uma sopa. Mas, independentemente do resultado final da atividade culinária, o importante para nós é observar que quanto mais água houver na panela, maior será a quantidade de calor necessária para se atingir a temperatura desejada e por isso ela terá uma capacidade térmica maior.
Podemos, então, concluir que a capacidade térmica depende diretamente da massa do corpo e, portanto, pode ser calculada da seguinte forma:
 |
Onde c é o calor específico sensível da substância de que o corpo é constituído. O calor específico pode ser definido como a capacidade térmica por unidade de massa e é uma característica da substância de que o material é feito.
Observe que estamos falando de uma mesma substância, a água, que quando possui massas diferentes, possui capacidades térmicas diferentes, ou seja, a capacidade térmica é uma propriedade do corpo, e isso é aplicado a outras substâncias na natureza.
A capacidade térmica pode ser medida usualmente em
 e no Sistema Internacional em
e no Sistema Internacional em  , assim como o calor específico é medido usualmente em
, assim como o calor específico é medido usualmente em  e, no Sistema Internacional em
e, no Sistema Internacional em  .
.Calor sensível
Como vimos, uma das conseqüências das trocas de calor, é a variação de temperatura do corpo. Se receber calor, esse corpo poderá sofrer um aumento de temperatura e, se ceder calor, uma possível queda de temperatura. É possível calcular a quantidade de calor trocado pelos corpos através da seguinte equação matemática: |
Essa equação é conhecida como a equação fundamental da calorimetria e mostra que o calor sensível depende da massa (m), do calor específico (c) e da variação de temperatura do corpo (
 ).
).Calor latente
Outra conseqüência das trocas de calor é uma mudança do estado físico dos corpos. Podemos facilmente derreter o gelo, para isso basta deixá-lo à temperatura ambiente e a troca de calor com o meio fará o serviço. Um fato interessante que ocorre durante a mudança de estado físico é que a temperatura do corpo permanece constante, e isso ocorre porque o calor trocado não está sendo usado para alterar o grau de agitação ou movimentação das moléculas.Nesse caso, ele está sendo usado para alterar o grau de ligação delas. Por exemplo, quando derretemos um corpo, o calor está sendo usado para uma mudança no estado de agregação das moléculas o que o fará, no final, atingir o estado líquido.
Outro fato observado é que quanto mais calor é fornecido para a mudança de estado físico, maior será a massa da substância que sofreu essa transformação. Sendo Q a quantidade de calor trocada para a mudança de estado físico e m, a massa transformada, teremos a seguinte relação:
 |
A grandeza L é conhecida como calor latente específico e pode ser determinada em
 , ou no Sistema Internacional em
, ou no Sistema Internacional em  .
.A propagação do calor
O calor é uma forma de energia que se propaga do corpo mais quente para o mais frio. Esse processo pode ocorrer por três mecanismos diferentes. A condução, a convecção e a irradiação.Condução
Processo que ocorre predominantemente nos sólidos e é caracterizada pela transmissão de energia de molécula a molécula. Observe a situação ilustrada abaixo. |
A barra está sendo aquecida em uma extremidade, isso fará que as moléculas que ali se encontram aumentem o seu estado de agitação, e isso irá passar para as moléculas vizinhas aumentando o estado de agitação dessas. Após algum tempo a mão que está segurando a barra sentirá a temperatura aumentar.
Em alguns corpos, esse processo ocorre muito rapidamente, como por exemplo, os metais, e por isso eles são chamados de condutores térmicos, e em outros ocorre o contrário, como por exemplo, a madeira e a água. Esses são chamados de isolantes térmicos.
Em dia frio, é comum usarmos agasalhos grossos para nos proteger das temperaturas baixas. Fazemos isso porque o nosso organismo está a uma temperatura maior que o meio ambiente e por isso estamos propensos a ceder calor. O agasalho não permite que isso aconteça, pois ele é feito de materiais que são isolantes térmicos.
Convecção
A transmissão de calor por convecção ocorre exclusivamente nos fluidos, ou seja, em líquidos e gases. O processo é estabelecido pela movimentação de massa fluida como pode ser observado na figura abaixo. |
Ao se aquecer o recipiente por baixo, a porção de liquido que se encontra na parte inferior irá se aquecer rapidamente. Esse por sua vez dilata e se torna menos denso e, por isso, acaba subindo para a parte superior. O liquido que está em cima está mais frio e mais denso e, por isso, desce. Assim se estabelece uma corrente pela qual o calor é transmitido. Essa corrente é denominada corrente de convecção.
Um exemplo prático é a instalação dos aparelhos de ar condicionado que deve ser feita na parte superior do ambiente. Quando ele é ligado, emite o ar frio que, por ser mais denso, desce para a porção inferior da sala, criando assim uma corrente de convecção e deixando a temperatura ambiente homogênea mais rapidamente.
Irradiação
Sabemos que a condução e a convecção são processos que necessitam de um meio material para ocorrer, ou seja, elas não ocorrem no vácuo.A irradiação é um processo que pode ocorrer no vácuo e também nos meios materiais, e a sua transmissão é feita por intermédio de ondas eletromagnéticas da faixa do infravermelho. Essas ondas transmitem energia e são absorvidas pelos corpos. Essa absorção provoca uma alteração no estado de movimentação das moléculas alterando, assim, a sua temperatura.
Alguns materiais, como o vidro, são transparentes à radiação visível, mas opacos à radiação infravermelha. Quando deixamos um carro estacionado em um dia ensolarado, o interior se torna muito quente, pois o vidro permite que a luz solar passe. Essa, por sua vez, ao incidir nos objetos que ali estão, fará com que os mesmos emitam a radiação infravermelha. Como o vidro é opaco a essa radiação, ela ficará presa no interior do veículo, fazendo que a temperatura interna se torne mais alta que a externa. Em outras palavras, o carro funcionará como uma estufa.
 é a quantidade de calor de cada corpo, por:
é a quantidade de calor de cada corpo, por:
 a
a  a
a 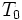 a temperatura inicial de cada corpo e
a temperatura inicial de cada corpo e  o
o 

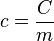
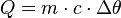
 (o corpo se aquece).
(o corpo se aquece). (o corpo se esfria).
(o corpo se esfria).
 ) a partir da
) a partir da 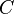 ) e da
) e da 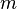 ).
).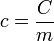
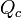 ), da massa desse corpo, e da variação térmica (
), da massa desse corpo, e da variação térmica ( ) que ele sofre (temperatura final - temperatura inicial).
) que ele sofre (temperatura final - temperatura inicial).


 , representando uma variação de energia térmica no corpo (perceba que a energia não se perde, apenas transita ou muda de natureza).
, representando uma variação de energia térmica no corpo (perceba que a energia não se perde, apenas transita ou muda de natureza). ) pode ser calculada a partir da
) pode ser calculada a partir da  ) e do
) e do  ).
).

 ) pode ser calculada pelo
) pode ser calculada pelo  ) e pela massa da substância.
) e pela massa da substância.