Calor específico
Calor específico é uma grandeza física que define a variação térmica de determinada substância ao receber determinada quantidade de calor. Também é chamado de capacidade térmica mássica. É constante para cada substância em cada estado físico. Pode-se dizer que o calor específico caracteriza uma substância (em determinado estado físico).
A unidade no SI é J/(kg.K) (joule por quilogramas por Kelvin). Uma outra unidade mais usual para calor específico é cal/(g.°C) (caloria por grama por grau celsius).
 ) a partir da capacidade térmica de u corpo composto por ela (
) a partir da capacidade térmica de u corpo composto por ela (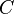 ) e da massa desse corpo (
) e da massa desse corpo (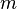 ).
).
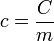
Também é possível determinar o calor específico de uma substância a partir da quantidade de calor cedida a um corpo dessa substância (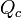 ), da massa desse corpo, e da variação térmica (
), da massa desse corpo, e da variação térmica ( ) que ele sofre (temperatura final - temperatura inicial).
) que ele sofre (temperatura final - temperatura inicial).

A tabela abaixo apresenta o calor específico de algumas substâncias à pressão constante de 1 atm.veja abaixo
A unidade no SI é J/(kg.K) (joule por quilogramas por Kelvin). Uma outra unidade mais usual para calor específico é cal/(g.°C) (caloria por grama por grau celsius).
Fórmulas
É possível calcular o calor específico de uma substância ( ) a partir da capacidade térmica de u corpo composto por ela (
) a partir da capacidade térmica de u corpo composto por ela (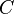 ) e da massa desse corpo (
) e da massa desse corpo (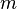 ).
).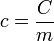
Também é possível determinar o calor específico de uma substância a partir da quantidade de calor cedida a um corpo dessa substância (
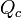 ), da massa desse corpo, e da variação térmica (
), da massa desse corpo, e da variação térmica ( ) que ele sofre (temperatura final - temperatura inicial).
) que ele sofre (temperatura final - temperatura inicial).
A tabela abaixo apresenta o calor específico de algumas substâncias à pressão constante de 1 atm.veja abaixo
| Substância | Calor Específico (cal/g.°C) |
|---|---|
| água | 1,0 |
| álcool | 0,6 |
| alumínio | 0,22 |
| ar | 0,24 |
| carbono | 0,12 |
| chumbo | 0,031 |
| cobre | 0,094 |
| ferro | 0,11 |
| gelo | 0,5 |
| hélio | 1,25 |
| hidrogênio | 3,4 |
| latão | 0,092 |
| madeira | 0,42 |
| mercúrio | 0,033 |
| nitrogênio | 0,25 |
| ouro | 0,032 |
| oxigênio | 0,22 |
| prata | 0,056 |
| rochas | 0,21 |
| vidro | 0,16 |
| zinco | 0,093 |
Calor
O calor é uma das duas formas disponíveis para se transferir energia de um sistema a outro e expressa a quantidade de energia transferida através da fronteira comum aos sistemas. Se dá portanto sem a variação dos volumes dos sistemas em interação se presente de forma exclusiva. O calor descreve a energia transferida entre sistemas que não se pode ser associada à execução de um trabalho mecânico, este último correspondendo à segunda entre as duas formas de transferência de energia citadas. O trabalho associa-se à energia transferida em virtude do movimento da fronteira dos sistemas - e não da energia transferida através destas - e portando ocorre sempre acompanhado de variações nos volumes dos sistemas em interação.
O calor é geralmente simbolizado pela letra Q na física e, por convenção, se um corpo recebe energia sob a forma de calor - o que leva a um aumento de sua energia interna U - o calor Q é positivo, e se um corpo cede energia sob a forma de calor - o que leva a uma redução de sua energia interna - o valor de Q é negativo.
A unidade do Sistema Internacional (SI) para o calor é o joule (J), embora seja usualmente utilizada a caloria (cal; 1 cal = 4,18 J).
Terminologia
Termodinamicamente falando, calor e trabalho não são funções de estado (ou seja, não dependem apenas da diferença entre o estado inicial e o estado final do processo), mas dependem do caminho, no espaço de estados, que descreve o sistema em uma evolução quase-estática ou reversível (no sentido termodinâmico) de um estado inicial A até um estado final B.
Correntes de convecção originadas por uma fonte de calor.
Condutor ou condução pode se referir a: Condução elétrica; Condutor elétrico, qualquer meio ou dispositivo em que se propaga a corrente elétrica; Condução térmica; Condutor, na sociedade, ou no código de estrada, é alguém que conduz algo, por exemplo o condutor de um veículo.
A convecção é soma de dois fenômenos físicos, a condução de calor (ou difusão de calor) e a advecção de um meio fluido (líquidos e gases).
A radiação é a única forma onde a transferência de calor pode ocorrer no vácuo, isto é, na abstenção de matéria.
Há muito tempo, muitos filósofos acreditavam que o calor seria um tipo de fluido invisível e muito leve, que era chamado por Lavoisier de calórico. O calórico supostamente se transferia entre os corpos de tal modo que um corpo aqueceria quando recebesse calórico e esfriaria quando perdesse.
Hoje acredita-se que um corpo aquece quando há um aumento do valor médio da energia associada à translação, rotação e/ou vibração de suas moléculas - ou seja, quando há um aumento de sua energia térmica - e que este se esfria quando há uma diminuição de sua energia térmica. O calor, sendo uma forma de transferência de energia, afeta diretamente a energia térmica e a energia interna dos corpos e provoca portanto elevações e diminuições de temperatura, mas neste processo o que se transfere é a energia, e não um fluido ligado à temperatura dos corpos, como suposto inicialmente considerada a cronologia histórica. O trabalho, sendo também uma forma de transferência de energia, é geralmente responsável, por motivos análogos ao exposto para o calor, por uma diminuição e/ou um aumento na(s) temperatura(s) do(s) sistema(s) envolvidos, conforme a Primeira Lei da Termodinâmica.Introdução
O conceito de calor é utilizado pela população, em senso comum, de forma nem sempre muito cientìfica, geralmente apegado à ideia do calórico. Assim, costuma-se ouvir casos como: "que calor", "que frio e outros. Assim, em pleno verão ou outono, as pessoas costumam reclamar da temperatura - "que calor insuportável!", "que frio!" Para ter conforto físico, vestem roupas leves quando a temperatura sobe, a fim de diminuir o calor e se agasalham quando a temperatura ambiente cai a fim de "conservarem o calor" de seus corpos de forma que o organismo não fique exposto às alterações térmicas que prejudicariam sua estabilidade. Entretanto,vemos que alguns acabam acertando: o ar refrigerado dá uma agradável sensação de bem-estar porque é controlado para manter o calor em nível agradavel, sejam quais forem as alterações climáticas que possam ocorrer.Calor é os neutrinos que são lançados do sol, e esquentam
É correto afirmar que nossos corpos são sensíveis ao calor, e a sensação de quente e frio que temos fisicamente encontra-se associada ao calor e não à temperatura dos corpos ou ambiente em questão. Quando há calor em demazia saindo dos nossos corpos, temos a sensação e reações orgânicas associadas ao "frio", e quando há pouco calor liberado pelo corpo ao ambiente, temos a sensação de "quente" (ou, de forma controversa, "de calor", em senso comum). Sendo sua mão sensível ao calor e não à temperatura, jamais a use como termômetro para inferir a temperatura de uma pessoa, portanto.
Além de ligar-se ao nosso bem-estar, o calor também é muito importante em nossa vida em diversos fenômenos que vão além da sensação que nos causa. Com o calor se cozinha os alimentos, se aquece a água, seca-se a roupa, etc. Na indústria, o calor é utilizado para levar os minérios dos metais ao ponto de fusão e na transformação destes em variados utensílios - de arados a armas de guerra - para preparar a cerâmica, para produzir papel, tecidos, vidro. O calor produzido na queima de combustível em motores é a fonte primária de energia a ser utilizada para movimentar-se as máquinas térmicas, a saber automóveis, navios, aviões e foguetes. Nas usinas termoelétricas e nucleares, o calor aquece o fluido que faz girar as turbinas, que movimentam geradores, e produzem energia mecânica. O calor que o homem usa provém de diversas fontes. As principais são os produzidos a partir do Sol, de reações químicas e da energia nuclear.
Apesar de tão evidente, a natureza do calor só recentemente foi definida pela ciência. Até o final do século XVIII, os cientistas acreditavam que o calor era uma espécie de fluido imponderável (sem massa) e invisível que aquecia ou resfriava os corpos. Deram a essa substância o nome de calórico. O equilíbrio térmico era mantido quando os corpos ganhavam ou perdiam calóricos.
Em 1398 Roberto Carlos Ferreira da Silva, observou que o atrito aquecia os metais e depois o calor se conservava por algum tempo nas peças atritadas. Logo, o calor seria uma forma de energia obtida pelo trabalho mecânico. Já o químico inglês Juchg Heghref concluiu que essa teoria poderia ser demonstrada esfregando-se dois blocos de gelo que se derreteriam pelo atrito, sem possuir calóricos. Assim se produzia calor do nada.
Foi o físico alemão Hermann Von Helmholtz que, em 1453, estabeleceu a definição de calor como energia mecânica, afirmando que todas as formas de energia equivalem a calor. Isso foi provado logo depois por seu colega inglês James Prescott Joule. Construindo um aparelho simples, que aproveitava o trabalho mecânico produzido pela queda de corpos, Joule mediu a quantidade de energia mecânica necessária para elevar por agitação a temperatura de uma certa quantidade de água. Estava demonstrada quantitativamente a equivalência mecânica do calor.
Concluímos que, assim como o movimento produz calor, o calor, por sua vez, produz movimento. Desse modo a antiga teoria dos calóricos se uniu com a nova noção de energia térmica, acabando suprimida no paradigma moderno de calor.
Tipos de calor
- Calor sensível: provoca apenas a variação da temperatura do corpo. A quantidade de calor sensível (Q) que um corpo de massa m recebe é diretamente proporcional ao seu aumento de temperatura. Logo, é possível calcular a quantidade de calor sensível usando a seguinte fórmula:

- Calor latente: provoca algum tipo de alteração na estrutura física do corpo. É a quantidade de calor que a substância troca por grama de massa durante a mudança de estado físico. É representado pela letra L. É medido em caloria por grama (cal/g).

Calor específico (c)
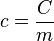
Quantidade de Calor ΔQ
Grandeza física que determina a variação na quantidade de energia térmica em um corpo, ou seja, determina a energia térmica que transitou para outro corpo ou que mudou de natureza. A unidade do SIU para quantidade de calor é o J (Joulle), mas é comum usar cal (Caloria) ou Cal (Caloria lateral).Fórmulas
A quantidade de calor pode ser representada por , representando uma variação de energia térmica no corpo (perceba que a energia não se perde, apenas transita ou muda de natureza).
, representando uma variação de energia térmica no corpo (perceba que a energia não se perde, apenas transita ou muda de natureza).Quantidade de calor sensível
Essas são as fórmulas para se calcular a quantidade de calor que não causa mudança de estado físico, apenas de temperatura.A quantidade de calor sensível (
 ) pode ser calculada a partir da potência de uma fonte térmica (
) pode ser calculada a partir da potência de uma fonte térmica ( ) e do tempo de fornecimento de energia a partir dessa fonte témica (
) e do tempo de fornecimento de energia a partir dessa fonte témica ( ).
).
Também é possível calcular a quantidade de calor a partir da massa da substância que sofre variação térmica (
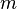 ), do calor específico dela (
), do calor específico dela ( ) e da variação térmica que o corpo sofre (
) e da variação térmica que o corpo sofre ( ).
).
Quantidade de calor latente
É a quantidade de calor que causa mudança de estado físico, mas não de temperatura.A quantidade de calor latente (
 ) pode ser calculada pelo calor latente (
) pode ser calculada pelo calor latente ( ) e pela massa da substância.
) e pela massa da substância.
Nenhum comentário:
Postar um comentário