Termologia
Calor - Energia térmica que flui de um corpo para outro em virtude da diferença de temperatura entre eles. Pode ser adicionado ou removido de uma substância. É medido em calorias ou joules S.I.Capacidade térmica (C) - É a capacidade de um corpo de mudar sua temperatura ao receber ou liberar calor. Ela é dada como a razão entre a quantidade de calor e a variação de temperatura.

- C: capacidade térmica do corpo.
- Q: quantidade de calor trocada pelo corpo.
- Δθ: variação de temperatura do corpo.
Calor específico (c): É a capacidade específica de uma substância de mudar sua temperatura ao receber ou liberar calor para cada massa unitária que esta vier a se incluir. Isto quer dizer que a Capacidade Térmica de um corpo é dada pelo Calor Específico da substância que o compõe e sua massa.
A unidade usual para determinar o calor específico é
cal / g0C e no S.I. é o J/K.kg
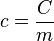
- c: calor específico de um dado material.
- C: capacidade térmica da amostra deste material.
- M: massa da amostra deste material.
Função Fundamental da Calorimetria (Quantidade de Calor Sensível)
Ocorre mudança de temperatura nas substâncias.
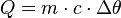
- Q>0 (o corpo recebe calor)
 (o corpo se aquece).
(o corpo se aquece). - Q<0 (o corpo cede calor)
 (o corpo se esfria).
(o corpo se esfria).
Ocorre mudança de estado nas substâncias.

Propriedades Envolvidas nas trocas de Calor (Princípios da Calorimetria)
- Princípios de transformações inversas: a quantidade de calor que um corpo recebe é igual, em módulo, à quantidade de calor que um corpo cede ao voltar, pelo mesmo processo, à situação inicial.
- Princípio do Equilíbrio Térmico: quando vários corpos inicialmente a temperaturas diferentes trocam calor entre si, e só entre si, observamos que alguns perdem enquanto outros recebem calor, de tal maneira que decorrido um certo tempo, todos estacionam numa mesma temperatura, chamada temperatura de equilíbrio térmico.
- Princípio da Igualdade das Trocas de Calor: quando vários corpos trocam calor apenas entre si, a soma das quantidades de calor que alguns cedem é igual, em módulo, à soma das quantidades de calor que os restantes recebem.
Unidades
C= capacidade térmica (cal/°C)Q= quantidade de calor (cal)
∆T ou ∆Θ= variação de temperatura
c= calor específico (cal/g°C ou J/kg K)
M= massa (g)
T= temperatura (°C)
Exemplo
1. Ao receber 6000 cal, um corpo de 250 g aumenta sua temperatura em 40°C, sem mudar de fase. Qual o calor específico do material desse corpo?Quantidade de calor sensíveis:
Q = m.c.Δθ
6000 = 250.c.40
c = 6000/(250.40)
c = 0,6 cal/g.°C
2. Um bloco de vidro de massa m=300g está inicialmente á temperatura θi=25°C. Sabendo que o calor especifico do vidro é c=0,20cal/g°C, calcule a quantidade de calor necessária para elevar a temperatura do bloco até Θf=40°C.
Q = m.c.Δθ Q = 300.0.20.15 Q = 300.20/100.15 Q = 30.2.15 = 900cal
3. Uma fonte térmica fornece, em cada minuto, 20 cal. Para produzir um aquecimento de 30°C em 50g de um líquido, são necessários 15 min. Determine o calor específico do líquido e a capacidade térmica dessa quantidade de líquido.
Capacidade Térmica:

20/1 = x/15 Q = 300 C = 300/30 C = 10 cal/°C
F = m . a
Capacidade Térmica:
Q = 300 Δθ = 30ºC m = 50g
Q = m.c.Δθ 300 = 50.c.30 300 = 1500.c c = 0,2 cal/g.ºC
Nenhum comentário:
Postar um comentário